Termometria, Calorimetria e Dilatação
Termometria
- Temperatura - É a grandeza física escalar que associamos ao estado de agitação das partículas que constituem um corpo.
A unidade de temperatura no \(SI\) é o Kelvin (K), sendo esta uma das sete unidades básicas do Sistema Internacional de Unidades. Entretanto, em muitos países são utilizadas outras escalas. No Brasil, a temperatura é medida em graus Celsius (°C), e nos Estados Unidos em graus Fahrenheit (°F).
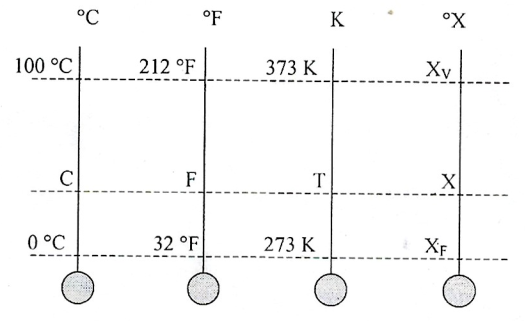
Para pdermos relacionar uma mesma temperatura em diferentes escalas, devemos estabelecer uma conversão entre essas escalas. - Escalas de Temperatura - Conversão $$\frac{C}{5}=\frac{F-32}{9}=\frac{T-273}{5}=\frac{X-X_{f}}{X_{v}-X_{f}}$$ onde X é a medida numa escala arbitrária, sendo \(X_{f}\) e \(X_{v}\) as medidas correspondentes às temperaturas de fusão e vaporização da água nessa escala.Observe que uma variação de \(100°C\) corresponde a uma variação de \(180°F\) e a uma variação de \(100K\). Em particular, variações de temperatura nas escalas Celsius e Kelvin são iguais. Temos que: $$\Delta C = \Delta T =\frac{5}{9}.\Delta F$$
Calorimetria
- Energia Térmica - É a soma das energias cinéticas de todas as partículas que constituem um corpo.
- Calor - É a energia térmica em trânsito de um corpo para outro, motivada por uma diferença de temperatura entre eles. Sendo uma forma de energia térmica, sua unidade de medida no SI é o Joule (J), embora na prática seja bastante utilizada também a caloria (1 cal = 4,186 J).
Assim, só existe troca de calor entre dois corpos se entre eles existir uma diferença de temperaturas. O calor se transfere do corpo mais quente para o corpo mais frio, até que os dois atinjam a mesma temperatura final de equilíbrio.
Quando dois corpos estão à mesma temperatura, dizemos que eles estão em equilíbrio térmico, e nesse caso não há troca de calor entre eles. - Lei Zero da Termodinâmica - Dados trẽs corpos A, B e C, se A está em equilíbrio térmicocom C, e B também está em equilíbrio térmico entre si.
- Calor Sensível - Calor necessário para produzir exclusivamente uma variação na temperatura de um determinado corpo. É dado por: $$Q=m.c.\Delta \theta = C.\Delta \theta$$ \(C=m.c\) é chamada de capacidade térmica de um corpo, e \(c\) é o calor específicio sensível de um corpo.
- \(Q \gt 0 \Leftrightarrow \Delta \theta \gt 0 \Leftrightarrow \) corpo recebe calor
- \(Q \lt 0 \Leftrightarrow \Delta \theta \lt 0 \Leftrightarrow \) corpo cede calor
- Calor Latente - Calor responsável por produzir exclusivamente uma mudança de stado física num determinado corpo. É dado por: $$Q=m.L$$ onde \(L\) é o calor latente da mudança de estado.
- \(Q \gt 0 \Leftrightarrow L \gt 0\) mudança ednotérmica
- \(Q \lt 0 \Leftrightarrow L \lt 0\) mudança exotérmica
Numa substância pura submetida a pressão constante, enquanto transcorre uma mudança de estado a temperatura se mantém constante.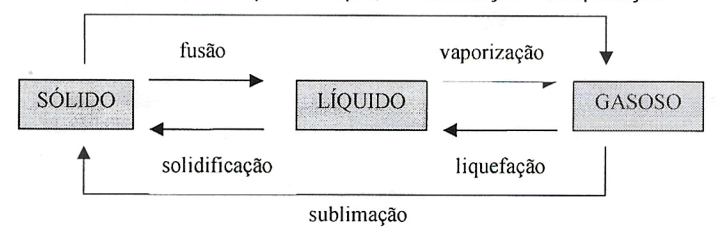
Gráfico de mudança de estado:Quando colocamos diversos corpos, a diferentes temperaturas, em contato térmico, ocorrem trocas de calor entre eles até que seja atingido equilíbrio térmico. Durante esse processo, podem ocorrer inclusive mudanças de estado físico de alguns deles. Se pudermos desprezar as perdas de calor para o ambiente (por exemplo, num sistema adiabático), a temperatura final de equilíbrio pode ser encontrada impondo a conservação da energia do sistema.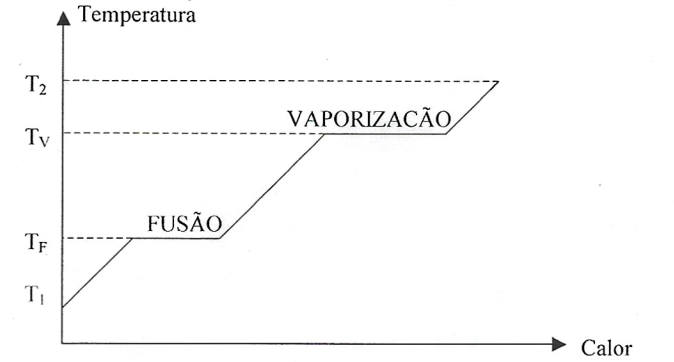
Equilíbrio Térmico: \(\sum Q_{cedido} + \sum Q_{recebido} = 0\)
Propagação do Calor
- Condução - A energia térmica vai sendo transmitido de uma molécula para outra do corpo. O fluxo de calor que se estabelece nesse caso será diretamente proporcional à área e à diferença de temperatura, e inversamente proporcional ao comprimento (espessura). $$\phi = \frac{Q}{\Delta t}=\frac{k.A.\Delta \theta}{L}$$
- Convecção - A energia térmica é transmitida através do deslocamento de porções do material.
- Radiação - A energia térmica é transmitida através de ondas eletromagnéticas (ondas de calor).
Os fênomenos da condução e da convecção necessitam de um meio material para sua ocorrência, enquanto a radiação, por ser transmissão através de ondas eletromagnéticas, pode ocorrer no vácuo (como o calor vindo do Sol, por exemplo.)
Dilatação
- Dilatação Linear - Quando a variação das medidas de um corpo, devido a uma variação de temperatura, é significante em apenas uma dimensão, temos a dilatação linear: $$\Delta L= L_{0}.\alpha .\Delta \theta$$
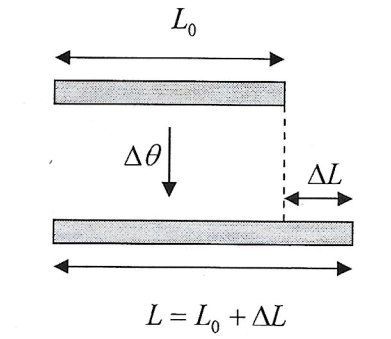
- Dilatação Superficial - Quando a variação das medidas de um corpo devido a uma variação de temperatura, é significante em apenas duas dimensões, temos a dilatação superficial:
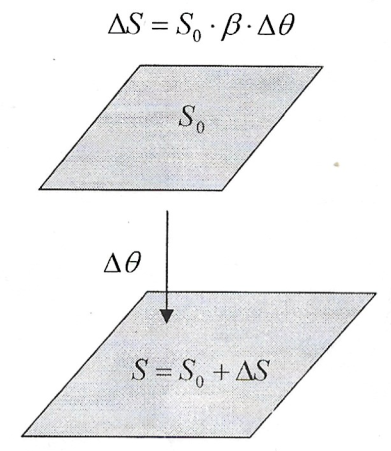
- Dilatação Volumétrica - Quando a variação das medidas de um corpo, devido a uma variação de temperatura, é significante em todas as dimensões, temos a dilatação volumétrica:
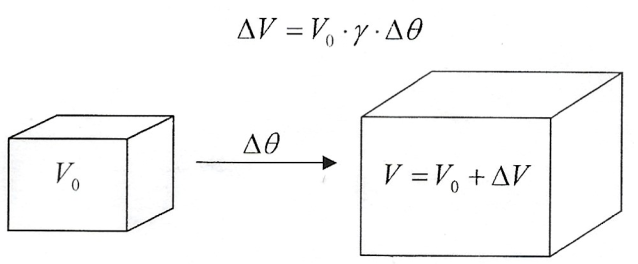 Relação entre os coeficientes de dilatação: $$\frac{\alpha}{1}=\frac{\beta}{2}=\frac{\gamma}{3}$$
Relação entre os coeficientes de dilatação: $$\frac{\alpha}{1}=\frac{\beta}{2}=\frac{\gamma}{3}$$ - Dilatação em Liquidos - Nos liquidos, ocorre exclusivamente a dilatação volumétrica. Porém, como o liquido estará sempre contido dentro de um recipiente, devemos levar em conta o efeito da dilatação, devido à variação de temperatura, também sobre o frasco que o contém. Visualmente, o que observamos é apenas a dilatação aparente. Para obtermos a dilatação real, devemos somar a dilatção aparente com a dilatação do recipiente. $$\Delta V_{liquido} = \Delta V_{frasco} + \Delta V_{aparente}$$ $$\gamma_{liquido} = \gamma_{frasco} + \gamma_{aparente}$$
Gases Perfeitos
A equação de Clapeyron relaciona as três variáveis de estado de um gás: pressão, volume e temperatura. $$p.V=n.R.T$$ Onde n é o número de mols do gás, R é a constante universal dos gases perfeitos \(R=0,082.\frac{atm.l}{mol.K}=8,31.\frac{J}{mol.k}\)
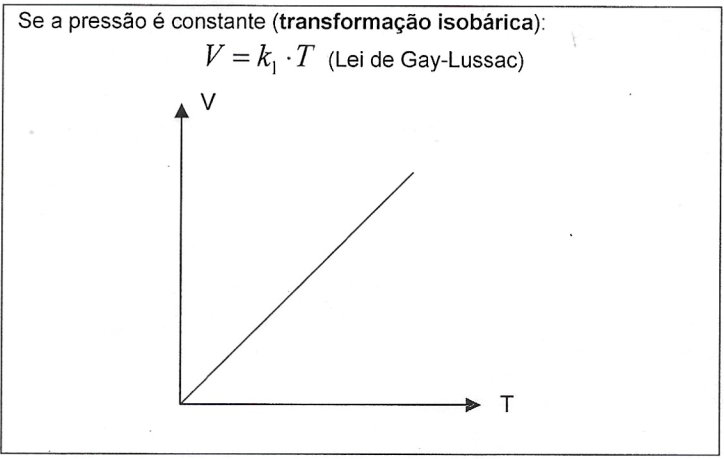
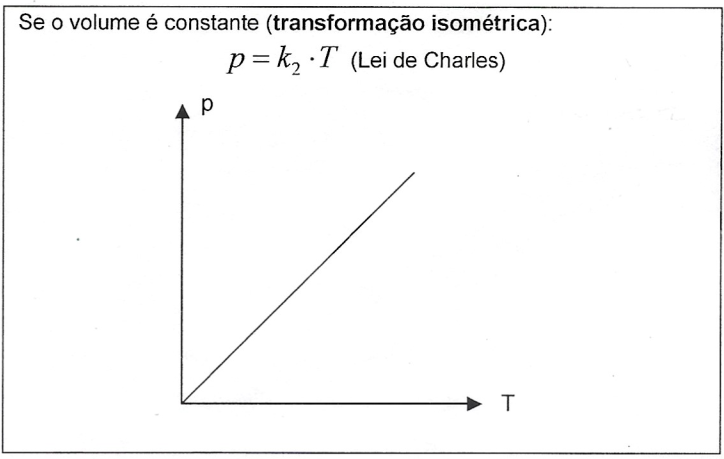
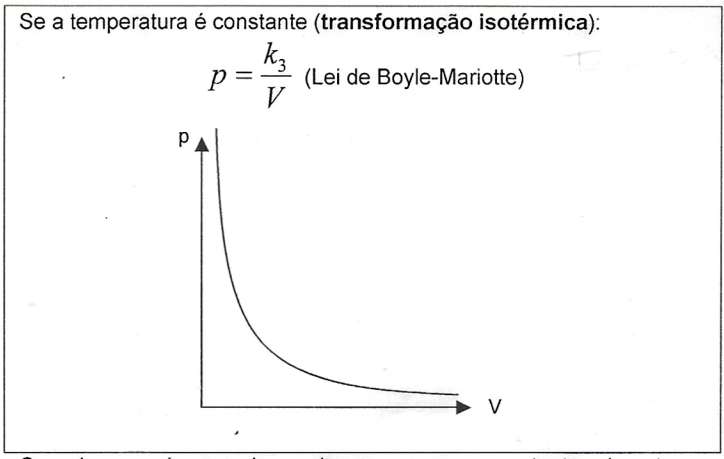
Quando o número de mols permanece constante durante a transformação, temos a Lei Geral dos Gases Perfeitos: $$\frac{p_{1}.V_{1}}{T_{1}}=\frac{p_{2}.V_{2}}{T_{2}}$$ Numa mistura de k gases perfeitos, supondo que eles não reajam entre si, temos que: $$n_{M}=n_{1}+n_{2}+...+n_{k}$$ Portanto: $$\frac{p_{M}.V_{M}}{T_{M}}=\frac{p_{1}.V_{1}}{T_{1}}+\frac{p_{2}.V_{2}}{T_{2}}+...+\frac{p_{k}.V_{k}}{T_{k}}$$
Termodinâmica
- Energia Interna de um Gás: $$U=\frac{3}{2}.p.V=\frac{3}{2}.n.R.T$$
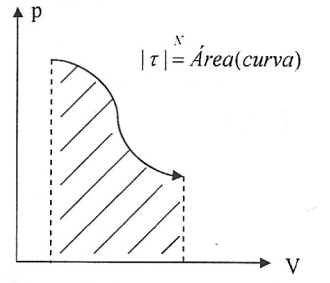
- Trabalho - Dizemos que um gás realiza trabalho quando sofre uma transformação na qual o seu volume aumenta, e que ele recebe trabalho quando sofre uma transformação na qual o seu voluma diminui. Quando a transformação sofrida pelo gas é caracterizada através de um gráfico da pressão em função do volume, o módulo do trabalho é numericamente igual à área delimitada pela curva e pelo eixo das abscissas.
- \(\tau \gt 0 \Leftrightarrow \) volume aumentou
- \(\tau \lt 0 \Leftrightarrow \) volume diminuiu
- \(\tau = 0 \Leftrightarrow \) volume constante
Em particular, numa transformação isobárica (a pressão constante), temos: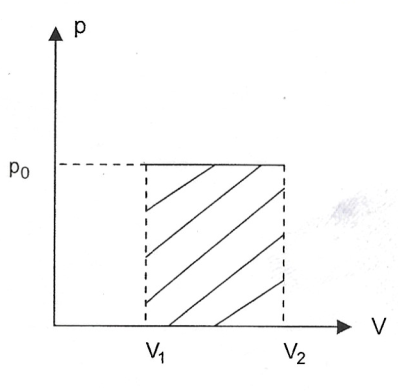
- 1º Lei da Termodinâmica - O calor (recebido ou fornecido) por um gás é em parte convertido em trabalho (realizado ou recebido) e parte convertido em energia interna. $$Q=\tau + \Delta U$$ O enunciado da 1º Lei da termodinâmica expressa a conservação da energia de um sistema: o calor que não é aproveitado em forma de trabalho é armazenado sob a forma de energia interna.
As convenções de sinal são as seguintes:- \(Q \gt 0 \Leftrightarrow \) calor recebido pelo gás
- \(Q \lt 0 \Leftrightarrow \) calor cedido pelo gás
- \(Q = 0 \Leftrightarrow \tau = - \Delta U \) (Transformação adiabática)
- \(\tau \gt 0 \Leftrightarrow \Delta V \gt 0 \Leftrightarrow \) gás realiza trabalho (expansão)
- \(\tau \lt 0 \Leftrightarrow \Delta V \lt 0 \Leftrightarrow \) gás recebe trabalho (compressão)
- \(\tau = 0 \Leftrightarrow \Delta V = 0 \Leftrightarrow Q = \Delta U\) (transformação isométrica)
- \(\Delta U \gt 0 \Leftrightarrow \Delta T \gt 0 \Leftrightarrow \) (aquecimento)
- \(\Delta U \lt 0 \Leftrightarrow \Delta T \lt 0 \Leftrightarrow \) (resfriamento)
- \(\Delta U = 0 \Leftrightarrow \Delta T = 0 \Leftrightarrow \) (transformação isotérmica)
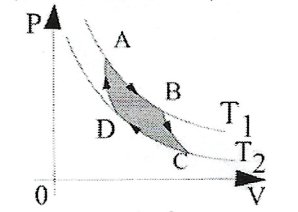
Num ciclo, a área dentro da curva fechado dá o módulo do trabalho realizado (sentido horário, \(\tau \gt 0\)) ou recbecido (sentido anti-horário, \(\tau \lt 0\)). Além disso, a variação de energia interna num ciclo é nula \(\Delta U_{ciclo}=0\)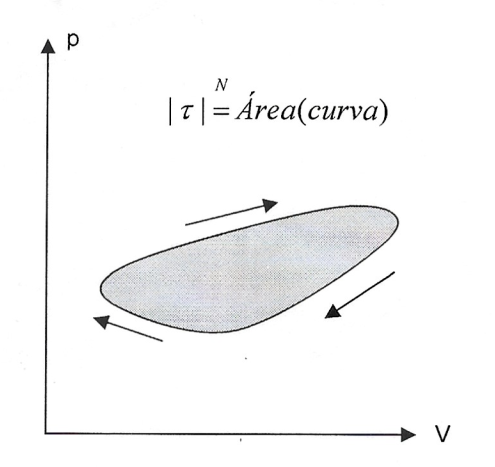
- Máquinas Térmicas - Uma máquina térmica realiza trabalho retirando calor de uma fonte quente, a uma temperatura \(T_{1}\) e rejeitando calor para uma fonte fria, a uma temperatura \(T_{2}\) sendo \(T_{2} \lt T_{1}\).O trabalho realizado, nesse caso, será dado ela diferença entre o calor retirado da fonte quente e o calor rejeitado para a fonte fria: $$\tau = Q_{1} - Q_{2}$$ A eficiência da máquina térmica será dada pela fração do calor fornecido pela fonte quente \(Q_{1}\) que é efetivamente convertido em trabalho \(\tau\). $$\eta = \frac{\tau}{Q_{1}}=1-\frac{Q_{2}}{Q_{1}}$$ A 2º Lei da Termodinâmica, entretanto diz que a eficiência de uma máquina térmica nunca será igual a 100%.
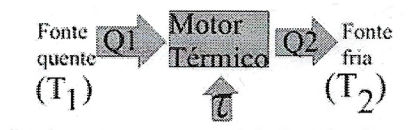
- 2º Lei da Termodinâmica - Uma máquina operand num ciclo não consegue transformar integralmente todo calorque recebe em trabalho. O rendimento máximo é aquele conseguido no ciclo de Carnot. $$\eta_{max} = 1 - \frac{T_{2}}{T_{1}}$$ $$\frac{T_{2}}{T_{1}}=\frac{Q_{2}}{Q_{1}}$$ O ciclo de Carnot está representado abaixo, operando entre duas adiabáticas (BC e DA), e duas isotermicas (AB e CD).